


诺华、赛诺菲、礼来、复星、拜耳等制药巨头纷纷布局,超百种干细胞疗法候选药品正在被开发,国际已经掀起以造血干细胞、间充质干细胞、多能干细胞(包括胚胎干细胞ESC和诱导多能干细胞iPSC)为主的干细胞技术转化研究热潮。
全球有19款干细胞产品获批上市,但暂无多能干细胞(ESC或iPSC)来源细胞产品获批上市。在国内,进入临床试验阶段的19个干细胞药品中,有18款属于间充质干细胞产品,尚未有多能干细胞(ESC或iPSC)来源产品获批进入I期临床试验。
人诱导多能干细胞(iPSC)作为细胞治疗产品的原材料种子细胞,可定向分化为多种功能细胞如NK细胞(iNK)、多巴胺能神经前体细胞(iDOPA)、间充质细胞(iMSC)、视网膜色素上皮细胞(iRPE)等,用于治疗恶性肿瘤、帕金森病、移植物抗宿主症、黄斑变性等难治性疾病。
中盛溯源在临床级iPSC制备、iPSC来源功能细胞成药、和新型质检方法开发等三个方向上深入研发,致力于推出高质量的iPSC来源细胞治疗产品。

张颖
中盛溯源研发总监
近日,在医麦客举办的BPIT 2021生物药创新技术大会上,中盛溯源研发总监张颖分享了《iPSC来源细胞药品研发现状与展望》主题演讲,并做客医麦客《峰客访谈》,就iPSC的行业发展现状和中盛溯源在干细胞全产业链的布局进行了对话,以下是访谈内容的整理。
iPSC来源细胞药品研发现状与展望
FENGCLUB
iPSC临床转化研究方面,以日本的进展最快应用方向最多,其次为美国和澳大利亚。
在日本,继2014年全球首次开展自体iPSC来源iRPE细胞治疗黄斑变性临床试验以来,日本监管机构先后批准多个大学和医院的研究者开展iPSC来源细胞治疗产品治疗帕金森病、再生障碍性贫血、脊髓损伤、头颈癌等疾病的临床研究IIT(Investigator Initiated Trial)。
这些机构使用的临床级iPSC均来自山中伸弥博士领衔的京都大学CiRA(Center for iPS Cell Research and Application)iPSC库,这些iPSC均采用了非病毒游离载体重编程方法,在实现免疫配型高覆盖的同时,避免了病毒残留和基因编辑HLA位点引入的风险。
在美国,自2018年以来,FDA已批准了Fate Therapeutics公司6款iPSC来源免疫细胞产品的IND(Investigational New Drug)申请,进入I期临床试验并显示了良好的肿瘤杀伤效果。此外,美国也有一些其它iPSC来源细胞药品处于研发阶段,如iPSC来源的胰岛细胞、iDOPA多巴胺能神经前体细胞和iRPE视网膜色素上皮细胞等。
澳大利亚CYNATA公司则是在iMSC临床试验方面走在世界前列。目前已开展多个适应症的研究,包括急性GVHD移植物抗宿主症、严重肢体缺血、膝骨关节炎和新冠病毒感染,其中膝骨关节炎临床试验已获澳大利亚药监部门批准进入III期。
iPSC来源细胞药物治疗癌症和神经退行性疾病
FENGCLUB
“当前,中国的创新药不管是在抗体、病毒还是细胞领域,与世界前沿水平差距已经比较小了。而且我认为基于中国的体量、研发实力以及研发速度,将来中国在创新药产业将会成为全球的领导力量之一,这与中国创新药的蓝海时代定义也是非常贴切的。”
在这片蓝海时代,张颖很清楚中盛溯源的定位:“我们主要是聚焦于iPSC技术的上下游以及相关医疗产品的开发。上游我们要建立科研级、临床级的iPSC细胞库,并完成相关的质量认证;下游将iPSC分化为各种人体功能细胞应用于科研和临床。”

“我们的主要目标是将iPSC分化的功能细胞开发成细胞药物,适用于目前未被满足的治疗需求,比如帕金森病和肿瘤等疾病。”
中盛溯源致力于癌症、神经退行性疾病等方向iPSC来源细胞药品的管线研发。
在iPSC来源免疫细胞治疗癌症方面,中盛溯源自主研发的iNK和iCAR-NK细胞产品正系统性验证肿瘤杀伤能力和安全性,稳步推进药品研发进程。
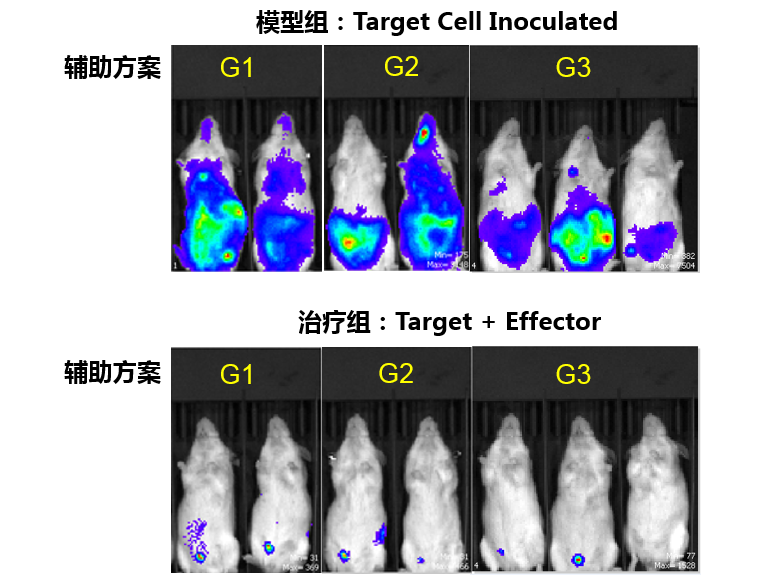
在iPSC来源多巴胺能神经前体细胞iDOPA治疗帕金森病方面,中盛溯源已实现从iPSC规模化生产iDOPA产品,正在开展系统的安全性和有效性评价工作。
值得一提的是,中盛溯源在细胞药物研发过程中,也在努力实现关键试剂和原材料的自主研发和供应。谈及原因,张颖博士坦言,进口试剂的质量和批次稳定性比在国外用的同样产品差很多,无法用于临床级细胞产品的稳定生产。
另外,只有能够掌握底层、关键性原材料的生产和供应,才能稳定地、可预期地去开发和生产细胞药物。从长远角度,这样的提前布局具有重要意义,可以使得中盛溯源不会置于进口试剂的供应链不确定风险之下。

中国首个《人诱导多能干细胞》标准发布执行
FENGCLUB
iPSC临床转化的先决条件是获得无外源基因残留的iPSC。早期iPSC重编程使用逆转录或慢病毒载体表达外源基因,外源基因的持续表达会影响iPSC来源细胞产品的获取和功能。
目前国际主流iPSC来源细胞产品(日本国内各大学医院、美国FATE THERAPEUTICS、澳大利亚CYNATA等)临床试验的产品生产均采用了非病毒游离载体重编程方法制备的iPSC作为种子细胞,其他也有个别非整合型病毒(如仙台病毒等)载体重编程工艺的临床试验备案,但总体来说只有游离载体或mRNA等非病毒重编程方法被美国FDA正在制订的iPSC来源细胞产品指导原则采纳。
中盛溯源采用具有自主知识产权的非整合游离载体重编程体系,经只需一次转染和常规传代培养就可以获得无痕iPSC,按照监管机构发布的相关指导原则完成临床级建库后的质量属性符合要求。
当前国内iPSC来源细胞产品还处于临床前研究阶段,建立统一的iPSC种子细胞的标准,对形成行业共识,促进iPSC临床应用标准化和普适化具有重要意义。2021年3月20日,由中盛溯源牵头起草的中国细胞生物学会《人诱导多能干细胞》团体标准在京发布,并于4月9日开始实施。这是我国首个人iPSC的产品标准,为人iPSC的生产和质量控制明确了最低要求,填补了国内空白。
对此,张颖表示,“我们希望随着iPSC技术临床转化的持续推进,在该项标准的基础上逐步建立临床级iPSC标准和指导原则,这对于保证iPSC来源细胞药物的产品质量,保障iPSC来源细胞产品的安全性具有非常重要的意义。”